Protocolo de transferencia Western
Jan 13, 2025
1. Extracción de proteína tisular total:
2.1 Lave el tejido 1-2 veces con PBS preenfriado, córtelo en trozos pequeños y colóquelo en un tubo de molienda, agregue 3 piezas de perlas de molienda de 3 mm y agregue 10 veces el volumen de tejido de la solución de lisis (por ejemplo: 100 mg de tejido, agregue 1000 ul de solución de lisis líquida), configure el programa de trituración para triturar tejido;
2.2 Retire el tubo de molienda después de moler y colóquelo en hielo o en una solución de lisis de cuarto grado durante 30 minutos;
2.3 Centrifugar a 12000 rpm, 4°C durante 10 minutos, recoger el sobrenadante, que es la solución de proteína total.
2. Determinación de la concentración de proteínas (opcional): determine la concentración de proteínas según sea necesario, tome la solución de proteínas sin desnaturalizar y utilice el kit de determinación de la concentración de proteínas BCA para medir la concentración de proteínas. Para conocer métodos específicos, consulte las instrucciones del kit;
3. Desnaturalización de proteínas:Agregue tampón de carga de proteína reducida 5* a la solución de proteína en una proporción de 4:1, desnaturalícelo en un baño de metal a 95°C durante 10 minutos y guárdelo en un refrigerador de -20°C o -80° para su uso posterior. ;
4. Electroforesis
4.1 Limpiar la placa de vidrio;
4.2 Preparación del gel y carga de muestras;
4.2.1 ①. Primero, mueva las placas de sujeción de ambos lados hacia abajo, abra completamente los prensaestopas de ambos lados, inserte el vidrio cóncavo y el vidrio plano desde arriba en diagonal y colóquelos hacia abajo. La parte superior del cristal queda pegada en las ranuras de ambos lados;
②. Levante los casquillos de ambos lados, pellizque la parte izquierda del casquillo con las manos al mismo tiempo, tire de la placa de sujeción izquierda hacia arriba y asegúrela en la parte superior; luego pellizque el lado derecho del casquillo al mismo tiempo, tire de la placa de sujeción derecha hacia arriba y fíjela. a lo más alto;
③. Después de confirmar que el vidrio de electroforesis está sujeto y alineado, desenrosque las perillas en ambos lados de la base de fabricación de gel, luego coloque el soporte de electroforesis en el medio de la base de fabricación de gel y sujételo, luego presione el soporte del cuerpo principal con las manos y Apriete las perillas en ambos lados hasta que gire hasta el límite.
4.2.2 Seleccione kits de fabricación de gel de diferentes concentraciones según los requisitos experimentales, mezcle las soluciones A y B en proporciones iguales y prepare la solución de gel inferior y la solución de gel superior respectivamente. Para placas de vidrio de diferentes especificaciones y espesores, los volúmenes de las soluciones de pegamento superior e inferior se pueden ajustar en proporciones iguales. Tomando como ejemplo la placa de gel de 8,3 cm × 7,3 cm (una sola pieza) comúnmente utilizada, el sistema de preparación recomendado es el siguiente:;
Grupo de formulación
Formulación
Placa de vidrio de 0,75 mm
Placa de vidrio de 1,0 mm
Placa de vidrio de 1,5 mm
Solución de pegamento inferior
10% Solución de pegamento inferior A
2 ml
2,5 ml
4ml
10% Solución de pegamento inferior B
2 ml
2,5 ml
4ml
AP
24 µL
30 µL
48 µL
Solución de pegamento superior
Solución de pegamento superior A
1 mililitro
1 mililitro
1,5 ml
Solución de pegamento superior B (color rojo)
1 mililitro
1 mililitro
1,5 ml
AP
12 µl
12 µl
18 µL
4.2.3 Después de ensamblar el fabricante de pegamento, primero agregue la solución de pegamento inferior preparada y luego use agua pura o etanol para sellar la superficie del pegamento inferior. Después de que el pegamento inferior se haya solidificado por completo (aproximadamente 10 a 15 minutos), deseche el agua o el etanol y use papel de filtro para absorber el líquido restante, luego agregue la solución de pegamento superior preparada, inserte el peine y espere a que se solidifique ( unos 10-15 minutos) antes de su uso;
4.2.4 Retire el cuerpo principal del generador de gel, saque con cuidado el peine y prepárese para iniciar la electroforesis;
5. Después de colocar el cuerpo principal del generador de gel en el tanque de electroforesis, llene el interior con tampón de electroforesis y agregue 1/3 con el exterior. Utilice un voltaje constante de 200 V durante 30 minutos hasta que el azul de bromofenol esté aproximadamente a 1 cm del fondo. La electroforesis finaliza y la electroforesis está lista para la transferencia.
6. Transferir película
6.1 Prepare 6 piezas de papel de filtro de transferencia de 7 × 9 cm (fino) y una membrana de PVDF de 5 × 8 cm. La membrana de PVDF debe activarse con etanol durante 2 minutos antes de su uso;
6.2 Coloque el clip de transferencia, dos esponjas, papel de filtro y membrana de PVDF activada en el recipiente con la solución de transferencia;
6.3 Extienda la carpeta de transferencia, con rojo a la izquierda y negro a la derecha. Agrega una esponja y tres trozos de papel de filtro a cada lado;
6.4 Retire con cuidado el pegamento de separación y colóquelo sobre el papel de filtro (el pegamento se coloca en el costado del clip de transferencia negro). Utilice el líquido de transferencia para enjuagar las burbujas del pegamento. Pegue lentamente la película de PVDF al pegamento. Tenga cuidado de que no queden burbujas. Luego pegue la película de transferencia por turno. Papel de filtro de membrana, esponja de transferencia;
6.5 Condiciones de transferencia (transferencia húmeda): Corriente constante, 300 mA durante media hora.
7. Respuesta inmune
7.1 Coloque la membrana transferida en una caja de incubación que contenga TBST, enjuáguela rápidamente, luego agregue 5 ml de leche desnatada al 5%, colóquela en una coctelera decolorante y bloquee a temperatura ambiente durante 30 minutos;
7.2 Según las instrucciones del anticuerpo, diluya el anticuerpo primario. Después de la configuración, vierta la solución de bloqueo en la caja de incubación, agregue el anticuerpo primario preparado e incube a 4 °C en un agitador durante la noche (agite el agitador lentamente);
7.3 Recupere el anticuerpo primario, enjuague la membrana rápidamente con TBST tres veces, luego agregue TBST, colóquelo en un agitador de tinción para una elución rápida, lave tres veces durante 5 minutos cada vez;
7.4 Diluir el anticuerpo secundario con TBST en una proporción de 1:5000, luego agregarlo a la caja de incubación, colocarlo en un agitador y agitar lentamente e incubar a temperatura ambiente durante 30 minutos;
7.5 Enjuague la membrana rápidamente con TBST tres veces, luego agregue TBST, colóquela en un agitador decolorante para una elución rápida, lave tres veces durante 5 minutos cada vez.
8. quimioluminiscenciaMezcle las soluciones ECL A y B en una proporción de 1:1 y reserve. Saque la membrana de PVDF eluida y colóquela sobre papel absorbente. Absorba ligeramente el líquido de la membrana y coloque la membrana en la ECL mezclada. En el líquido luminiscente, deje que el líquido sumerja completamente la membrana. Después de la reacción durante 1 minuto, saque la membrana y colóquela en la bandeja del instrumento de quimioluminiscencia. Inicie la quimioluminiscencia según el programa preestablecido. Una vez completada la exposición, guarde la imagen original en formato TIFF.
9. Resultados y análisis del BM

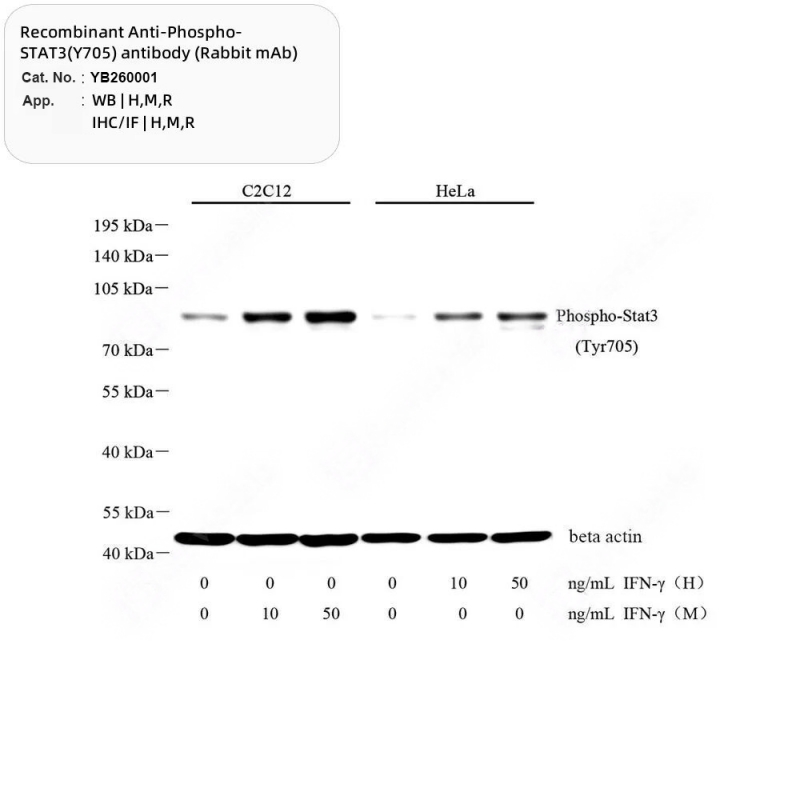









 RED SOPORTADA
Xml / política de privacidad
RED SOPORTADA
Xml / política de privacidad